カンナビジオールはSARS-CoV-2複製を阻害し、宿主の自然免疫応答を促進する
、*、1 、*、1 、*、2、9 、3 、4、^ 、4 、4 、6 、6 、1 、5 、2、9 、7 、8 、7 、6つの 、5 、4 、3 、#2、9及び #1
COVID-19の急速な蔓延は、新たな治療法の必要性を強調している。ここでは、大麻植物が生産する化合物であるカンナビジオール(CBD)がSARS-CoV-2の感染を抑制することを報告する。カンナビノイドではなく、CBDとその代謝物である7-OH-CBDは、肺上皮細胞におけるSARS-CoV-2の複製を強力に阻害する。CBDは細胞感染後に作用し、ウイルス遺伝子の発現を抑制し、SARS-CoV-2が宿主の遺伝子転写に及ぼす多くの影響を逆転させる。
CBDはインターフェロンの発現を誘導し、その抗ウイルスシグナル伝達経路をアップレギュレートする。過去にCBDを服用したことのあるヒト患者のコホートでは、マッチさせたペアや一般集団と比較して、SARSCoV-2感染の発生率が最大で1桁低くなった。今回の研究では、CBDとその活性代謝物である7-OH-CBDが、SARS-CoV-2の感染初期段階における予防薬および治療薬として期待できることが明らかになった。
SARS-CoV-2は、ポジティブセンス一本鎖RNA(+ssRNA)のエンベロープ型ウイルスで、脂質二重層と、ウイルス粒子の形成を促す4つの構造タンパク質から構成されている。
スパイク(S)、メンブレン(M)、エンベロープ(E)は、ウイルス膜に不可欠なタンパク質で、ウイルス粒子の出芽を促すとともに、ヌクレオカプシド(N)タンパク質とウイルスゲノムRNAを新生ウイルスに引き込む役割を果たしている。SARS-CoV-2は、SARS-CoVと同様に、主にウイルスのSタンパク質がアンジオテンシン変換酵素2(ACE2)受容体に結合することでヒトの細胞に侵入する(3-5)。その後、Sタンパク質は膜貫通型プロテアーゼ、セリン2(TMPRSS2)やその他のプロテアーゼによって分解され、2つの非共有結合ペプチド(S1、S2)になり、ウイルスの宿主細胞への侵入を促進する。
N末端のS1はACE2受容体と結合し、C末端のS2はTMRSS2や他のプロテアーゼによるタンパク質分解後にウイルスと細胞膜の融合を仲介する。細胞の種類によっては、ACE2が結合した後、タンパク質分解酵素の切断とは無関係にウイルスの侵入が起こることもある(6-8)。細胞侵入後、SARS-CoV-2のゲノムは2つの大きなポリペプチドに翻訳され、2つのウイルスプロテアーゼ、MProとPLProによって切断され(9, 10)、15種類のタンパク質が生成される。また、さらに10種類の付属タンパク質と4種類の構造タンパク質をコードするサブゲノムRNAが合成される。
これらのタンパク質は、ウイルスの複製、組み立て、出芽を可能にする。SARS-CoV-2β-コロナウイルスをはじめ、進化する病原性ウイルスの感染を抑制するために、私たちは、宿主のストレス応答経路を標的とするいくつかの低分子化合物の抗ウイルス性を検証した。
宿主のストレス反応や抗ウイルス性の炎症反応を調節する可能性のある物質として、カンナビノイドクラスの天然物の1つであるカンナビジオール(CBD)が挙げられます(11)。CBDは、カンナビス・サティバ(Cannabis sativa:カンナビス科、マリファナ/ヘンプ)が生産する物質です。麻とは、向精神薬であるテトラヒドロカンナビノール(THC)の含有量が0.3%以下で、一般的にCBDの含有量が比較的多い大麻植物またはその由来物を指します。
一方、マリファナは、乾燥重量で0.3%以上のTHCを含むC. sativaの材料を指します。THCはカンナビノイド受容体に結合して作用し、CBDはこの相互作用を増強します(12)。CBDを含む製品に関する多くの研究や多くの一般的に根拠のない主張にもかかわらず、CBD自体の生物学は不明であり、特定のターゲットもほとんど分かっていません(11)。しかし、CBDの経口溶液は、主にてんかんの治療薬としてFDAに承認されています(13)。
したがって、CBDは医薬品としてのステータスを持ち、治療薬として実行可能であり、米国ではダイエタリーサプリメントとして販売することはできません(11)。限定的ではありますが、ある種のカンナビノイドがC型肝炎ウイルス(HCV)やその他のウイルスに対して抗ウイルス作用を持つことを報告した研究もあります(14)。
結果
SARS-CoV-2の複製に対するCBDの効果を調べるために、外因性のヒトACE-2受容体を発現させたA549ヒト肺がん細胞(A549-ACE2)を、SARS-CoV-2の感染前に0〜10μMのCBDで2時間前処理した。48時間後、ウイルスのスパイクタンパク質の発現について細胞をモニターした(S)。
比較のため,HIVの抗ウイルス剤として知られるMLK阻害剤(URMC-099)(12)と,SARS-CoV-2によって引き起こされる遺伝子発現の多くの変化を元に戻す可能性があると我々が分析したPAK4/NAMPT阻害剤(13)であるKPT-9274も,同様の用量範囲で細胞を処理した.3つの阻害剤はいずれも,無毒性条件下でウイルスの複製を強力に阻害し,そのEC50は0.2~2.1μMであった(Fig.1A)。
CBDは、Vero E6サル腎臓上皮細胞においても同様にSARS-CoV-2の複製を阻害した(図S1A)。有効量では毒性は認められなかった(図S1B)。また、MHV受容体を発現するA549細胞(A549-MHVR)を用いて、CBDが無毒性条件下で、関連するβ-コロナウイルスであるマウス肝炎ウイルス(MHV)の複製をEC50〜5μMで抑制することを確認し、より広範なウイルスへの有効性が期待できることを示した(図S1C,D)。

カンナビジオール(CBD)は、invitroでのSARS-CoV-2感染の強力な阻害剤です。
(A)ACE2を過剰発現させたA549細胞(A549-ACE2)を、表示用量のCBD、KPT-9274、URMC-099で処理した後、SARS-CoV-2を感染多重度(MOI)0.5で48時間感染させた。
細胞をスパイク蛋白質で染色し、各条件でスパイク蛋白質を発現している細胞の割合をプロットした。EC50値を示す。(C)A549-ACE2細胞を3社のCBDで処理した後、SARS-CoV-2をMOI 0.5で48時間感染させた。
細胞をスパイクタンパクで染色し、各条件でスパイクタンパクを発現している細胞の割合をプロットした。EC50値を示す。
CBDは、天然の植物から抽出された場合、他のカンナビノイドと一緒に抽出されることが多く、天然物には避けられない複雑さがあります。CBDが実際にウイルス抑制効果を発揮していることを確認するために,CBDの基準物質と,3つの異なる供給源から得られたCBDを100%定量NMR(qNMR)で分析し,純度を調べた。
これらの供給元には、2つの化学物質の供給元(供給元AとB)と、天然素材を使用した1つの商業供給元(供給元C)が含まれる。実験的に得られた1H NMRと,最近確立された量子力学的HiFSA(1H Iterative Full Spin Analysis)プロファイルとの間に顕著な一致が見られたことから,1)使用された化合物が少なくとも97%の純度を持つCBDであること(Fig.1B),2)同属のカンナビノイドが1.0%以上のレベルで存在していないことが確認された(11)。
これらの異なるCBD製剤をウイルスA549-ACE2感染アッセイで分析したところ、EC50は0.6〜1.8μMの範囲で類似していたが、これはアッセイに内在する生物学的変動性を反映していると考えられる(Fig.1C)。また、ウイルス感染の抑制に使用した用量では、いずれのCBD製剤にも毒性は認められなかった(図S1 E-G)。
CBDは,C. sativaの抽出物の一部として消費されることが多く,特にマリファナ植物に濃縮されている精神活性の高いTHCと組み合わせて消費されることが多い。そこで我々は,同属のカンナビノイド,特に大麻植物が産生する構造と極性が密接に関連する類似体にも,SARS-CoV-2の感染を阻害する能力があるかどうかを調べた。
驚くべきことに、CBDだけが強力な抗ウイルス剤であり、生合成経路を共有し、C. sativaから精製されたCBDの生物遺伝学的に決定された残留複雑性を形成する構造的に近縁の同族体は、限定的または全く抗ウイルス活性を示さなかった。THC,カンナビディオール酸(CBDA),カンナビディバリン(CBDV),カンナビクロメン(CBC),カンナビゲロール(CBG)である(図2 A-B,「方法」参照)。
これらの化合物はいずれも、目的とする用量範囲でA549-ACE2細胞に毒性を示さなかった(図S2)。注目すべきは、CBDとTHCを1:1で組み合わせた場合、CBDの効果が著しく低下したことであり、これはTHCによる競合阻害と一致する。
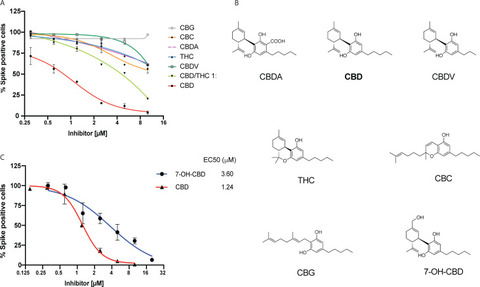
CBD以外のカンナビノイドによるSARS-CoV-2感染の阻害効果は限定的または全くない。
(A)A549-ACE2細胞を、表示用量の各種カンナビノイドまたはCBD/THC 1:1混合物で処理した後、SARS-CoV-2をMOI 0.5で48時間感染させた。細胞をスパイクタンパクで染色し、各条件でスパイクタンパクを発現している細胞の割合をプロットした。試験したすべてのカンナビノイドは、「方法」に記載したように、麻の抽出物から単離した。
(B) カンナビノイドおよび7-OH CBDの化学構造。(C)A549-ACE2細胞を指示用量の7-OH CBDで処理した後、SARS-CoV-2をMOI 0.5で感染させた。この細胞をスパイクタンパクで染色し、各条件でスパイクタンパクを発現している細胞の割合をプロットした。図1C(サプライヤーA)のCBDの代表的なデータを比較に用いた。EC50値を示す。
CBDは、肝臓や腸で急速に代謝され、7-カルボキシ-カンナビジオール(7-COOH-CBD)と7-ヒドロキシ-カンナビジオール(7-OH-CBD)の2つの主要代謝物になります。ヒトの血漿中の7-COOH-CBDの濃度は7-OH-CBDの40倍ですが、7-OHCBDはてんかんの治療に有効な成分です(14)。CBDと同様に、しかし他のカンナビノイドとは異なり、7-OH-CBDはA549-ACE2細胞におけるSARS-CoV-2の複製を効果的に阻害し(EC50 3.6μM;Fig.2C)、細胞には無毒性であった(fig.S2H)。
FDA承認のCBD(Epidiolex®)を服用している健康な患者の血漿中濃度を分析したところ、CBDの最大濃度(Cmax)はnMの範囲であるのに対し、7-OH-CBDのCmaxは培養細胞で観察されたのと同様にμMの範囲であった(15)。
これらの結果は、CBD自体は人でSARS-CoV-2を効果的に抑制するのに必要なレベルでは存在しないことを示唆している。一方、CBDの代謝物である7-OH-CBDの血漿中濃度は、Cmaxが高脂肪食との共投与により数倍に増加し、ヒトのSARS-CoV-2感染を抑制するのに十分なレベルである(15)。
CBDは、ウイルスの宿主細胞への侵入を阻止したり、感染後の段階で作用したりする可能性がある。CBDは、A549を含むいくつかの上皮細胞でACE2の発現を低下させることが示されている(16)ので、我々はまず、A549-ACE2過剰発現細胞においてCBDがSARS-CoV-2受容体を抑制するかどうかを調べた。
その結果、ACE2の発現低下は認められなかった(Fig.3A)。さらに,SARS-CoV-2のスパイクタンパク質またはVSVの糖タンパク質のいずれかでシュードタイプされたレンチウイルスの解析(17)では,スパイクタンパク質に対する抗体は,SARS-CoV-2のウイルス感染を効果的に阻止したが,VSV-Gを発現するウイルスは阻止できなかった。しかし、10μMのCBDはスパイク発現ウイルスの細胞侵入を部分的にしか阻害しなかったことから、抗ウイルス作用には他のメカニズムが大きく関与していることが示唆された(図3B、および図S3 A、B)。
一方、スパイクタンパク質に対する抗体は、SARS-CoV-2発現ウイルスのウイルス感染を効果的に阻止したが、VSV-G発現ウイルスは阻止しなかった。このことと矛盾しないように、CBDは、スパイクタンパク質に対する抗体の存在下で、感染後2時間でも宿主細胞でのSARS-CoV-2スパイクタンパク質の発現を抑制し、この期間中の再感染を防ぐのにも有効であった(図3C,,D).D)。
CBDがウイルスプロテアーゼMproまたはPLproによるウイルスタンパク質の処理を妨げている可能性を評価するために、in vitroでその活性を測定した(図S4)。CBDはどちらのプロテアーゼの活性にも影響を与えなかったことから、CBDが宿主細胞のプロセスを標的としている可能性が考えられる。
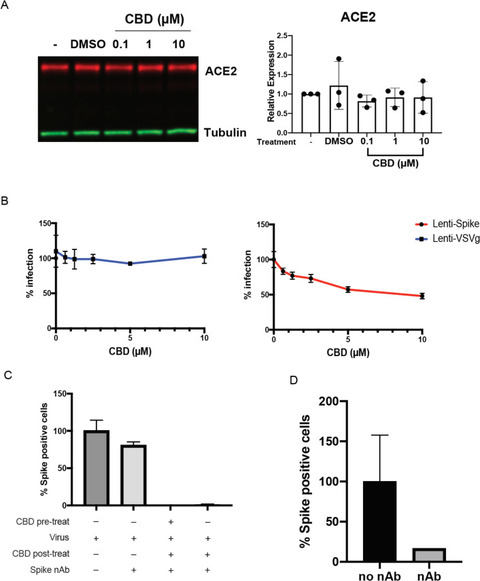
CBDは、SARS-CoV-2が宿主細胞に侵入した後のウイルス複製を阻害する。
(A)A549-ACE2細胞ライセートのACE2タンパク質発現のイムノブロット(未処理、ビヒクルまたはCBDを表示用量で処理)。ブロットは、ACE2およびチューブリンに対する抗体でプローブした。ACE2タンパク質の発現レベルは、各サンプルのチューブリンのシグナルで正規化した。ACE2の発現レベルを未処理のサンプルと比較してプロットした。発現レベルは、一方向のANOVAによりビークルと比較した。
(B)293T-ACE2細胞をスパイクまたはVSV-Gシュードウイルスで72時間感染させ、表示された用量のCBD処理を行い、感染した細胞の割合をプロットした。(C)A549-ACE2細胞は、10μMのCBDで2時間前処理するかしないかのいずれかを行い、次にSARS-CoV-2をMOI0.5で2時間感染させた。その後、細胞を10μMのCBDまたはDMSOで16時間処理し、スパイク中和抗体で再感染を防いだ。
スパイク陽性細胞を定量し、ウイルス感染しただけのサンプルに対して正規化した。(D)中和抗体の有効性の検証。400pfuのSARS-CoV-2ウイルスを、100μMの中和抗体とともに、または中和抗体なしで、1時間インキュベートした。A549-ACE2細胞をこの混合物で16時間処理し、Spike陽性細胞を定量した。
この解釈と一致するように、CBDで24時間処理した感染したA549-ACE2細胞のRNA-seq解析では、SARS-CoV-2に誘発された遺伝子発現の変化が顕著に抑制されていた。CBDは、スパイクタンパク質、膜タンパク質、エンベロープタンパク質、ヌクレオキャプシドタンパク質をコードするRNAを含む、宿主細胞におけるウイルスRNAの発現を効果的に根絶した(図4 AおよびB).B)。
SARS-CoV-2とCBDはそれぞれ、多くの転写因子を含む細胞内の遺伝子発現に大きな変化をもたらした(図S5、S6)。宿主細胞RNAの主成分分析では、ウイルスの変化がほぼ完全に反転したが、CBD+ウイルス感染細胞は、正常な細胞状態に戻るのではなく、CBDのみで処理した細胞に似ていた(図4C)。Metascapeを用いたクラスタリング分析により、いくつかの興味深いパターンと関連するテーマが明らかになった(図4D、図S7、S8)。
例えば、クロマチン修飾や転写に関連する遺伝子のウイルスによる誘導(クラスタ1)は、CBD単独では効果がないにもかかわらず、CBDによって逆転している。同様に、リボソームや好中球に関連する遺伝子のウイルスによる阻害(クラスター3)は、CBDによってほぼ逆転するが、薬剤単独では効果がない。これは、CBD単独が宿主のストレス応答に関連する遺伝子の強い活性化を誘導するクラスター5および6とは対照的である。
これらの結果を総合すると、CBDはウイルスのタンパク質翻訳とそれに伴う細胞の変化を防ぐ働きがあると考えられる。

SARS-CoV-2感染またはCBD治療後のウイルスおよび宿主細胞の転写の変化。A549-ACE2細胞は、MOIが3のSARS-CoV-2に、10μMで24時間のCBD処理の有無にかかわらず感染しました。RNA-seqは、メソッドで説明されているように実行されました。(A)RNA-seqサンプルからのSARS-CoV-2遺伝子の相対レベルのヒートマップ。(B)SARS-CoV-2スパイクおよびヌクレオカプシド遺伝子の発現レベル。感染およびCBD処理された細胞と比較した感染細胞からの遺伝子の発現レベルの変化率が各遺伝子について示されています。(C)コントロール(veh_mock)、SARS-CoV-2感染(veh_infect)、CBD処理(CBD_mock)、およびSARS-CoV-2感染とCBD処理(CBD_infect)を示すRNA-seqデータの主成分分析(PCA)サンプル。各サンプルの第1主成分と第2主成分(PC1とPC2)がプロットされます。(D)すべてのRNA-seqサンプルにわたる5,000個の最も可変的な遺伝子の正規化された発現レベルのヒートマップ、
CBDがウイルス感染を抑制し、ウイルスRNAの分解を促進する可能性のあるメカニズムの1つは、インターフェロンシグナル伝達経路の誘導によるものです。インターフェロンは、病原体への曝露に対する最も初期の自然免疫宿主応答の1つです(18)。SARS-CoV-2感染はインターフェロンシグナル伝達経路を抑制します(19)(、および図。S9)。ウイルスの非存在下と存在下の両方でCBDによって誘導されるいくつかの遺伝子には、インターフェロンベータとガンマの受容体、およびSTAT 1と2などのシグナル伝達経路のメディエーターが含まれます(と図。S10)。RNase Lの活性化とRNA分解を引き起こすインターフェロン誘導遺伝子であるOAS1のような経路の他の遺伝子(20)は、ウイルスの存在下でない限り、CBDによって有意に誘導されません(と図。S11)。これらの後者の結果は、CBDが有効なウイルス力価を十分に低下させて、インターフェロン経路の正常な宿主活性化を可能にする可能性と一致しています。同時に、CBDはサイトカインのウイルス誘導を効果的に逆転させ、感染の後期に致命的なサイトカインストームを引き起こす可能性があります()。まとめると、これらの結果は、CBDがインターフェロン経路を活性化することによってSARS-CoV-2感染を部分的に阻害し、ウイルスRNAの分解と、それに続くサイトカインを含む宿主遺伝子発現のウイルス誘発性変化をもたらすことを示唆しています。
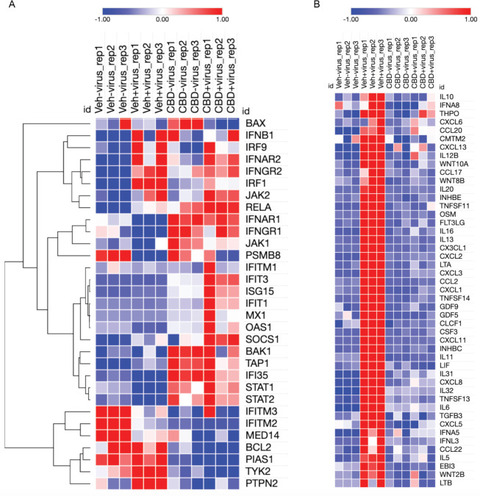
CBDは宿主細胞のインターフェロン応答を促進し、サイトカインのウイルス誘導を阻害します。(A)コントロール(veh_mock)、SARS-CoV-2感染(veh_infect)、CBD処理(CBD_mock)、SARS-CoV-を含むすべてのRNA-seqサンプルのインターフェロン応答カノニカルパスウェイからの遺伝子の正規化された発現レベルのヒートマップ2つの感染およびCBD処理(CBD_infect)サンプル。階層的クラスタリングが遺伝子に適用されました。(B)(A)に記載されているように、すべてのRNA-seqサンプルについて、ウイルス感染によってアップレギュレーションされたが、CBD処理によってダウンレギュレーションされたGOサイトカイン活性遺伝子の正規化された発現レベルのヒートマップ。
かなりの量のCBDを含むCBD製剤が多数の個人によって摂取されていることを考慮して、CBD曝露がSARS-CoV-2感染のリスク低下と相関するかどうかを調べました。シカゴ大学医療センターでSARS-CoV-2の検査を受けた93,000人を超える患者の分析では、全体で10.0%が陽性でしたが、医療記録にカンナビノイドが含まれていた約400人のうち5.7%のみが陽性でした()。CBDを服用している患者と他のカンナビノイドを服用している患者の検査陽性率はさらに低かった(85人のCBD患者で1.2%、他のカンナビノイドを服用している113人の患者で7.1%、p = 0.08)。他のカンナビノイドを服用している患者はウイルス感染に対する防御が弱いというこの発見は、私たちの細胞培養研究と一致しています。複数の潜在的な交絡因子は、年齢、人種、臨床病態、および性別など、これらの知見を、説明することができますので、我々は、経口処方された患者82人にマッチした、FDAが承認したCBD(Epidiolex ®の兆候がなかった患者にCOVID-19試験前)カンナビノイドを服用しているが、同様の人口統計学的特徴、臨床的併存疾患、およびCOVID-19検査前の2年間の他の薬物療法の記録を含む同等の他の特徴を持っていた(表S1)。COVID-19検査の前に経口CBDを処方された患者のうち、最も一般的な罹患率のカテゴリーは高血圧と免疫抑制を伴う状態でした。驚くべきことに、CBDを処方された患者のわずか1.2%がSARS-CoV-2に感染しましたが、一致した非カンナビノイド患者の12.2%が陽性であり(p = 0.009)、SARS-CoV-2感染リスクが約桁違い。
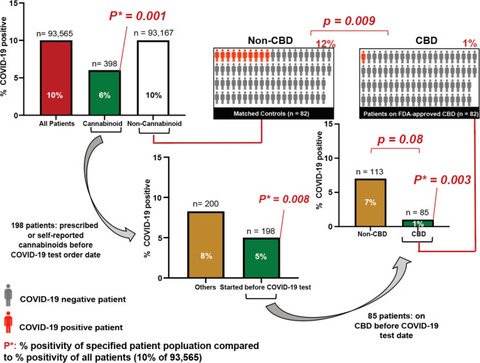
患者における高用量のCBD使用は、COVID-19陽性の低下と有意に相関しています。シカゴ大学医学部で検査された成人における、報告されたカンナビノイド薬の使用とCOVID-19検査結果との関連(合計n = 93,565)。P *:すべての患者の陽性率と比較した特定の患者集団の陽性率のp値(93,565人の患者で10%のCOVID-19陽性)。右中:85人の患者がCOVID検査日の前にCBDを服用しました。アッパーは、右:85人の患者の82は、FDAが承認したCBD(Epidiolex取っ®を)し、彼らの人口統計とその記録の診断および治療薬に応じて患者を獲得した最近傍傾向スコアモデルで93167人の患者(適合コントロール)の82にマッチさせました彼らのCOVID-19テストの2年前から。P値は、フィッシャーの直接確率検定の両側を使用して計算されました。
議論
私たちの結果は、CBDが感染の初期段階でSARS-CoV-2感染を阻止することができ、CBD投与がヒトにおけるSARS-CoV-2感染のリスクの低下と関連していることを示唆しています。さらに、患者の活性化合物は、てんかんのCBD治療に関係しているのと同じ代謝物である7-OH-CBDである可能性があります。FDA承認のCBDを服用した患者におけるSARS-CoV-2感染リスクの約1桁の大幅な減少は、SARS-CoV-2感染との闘いにおけるこの薬の潜在的な有効性を浮き彫りにします。最後に、MHVの複製を阻害するCBDの能力は、CBDが将来発生する新しい病原性ウイルスに対して有効である可能性を高めます。
CBDの抗ウイルス活性に寄与する1つのメカニズムは、ウイルス性病原体に対する宿主の免疫応答の活性化に続いて、直接的および間接的にインターフェロン経路を誘導することです。実際、インターフェロンはCOVID-19の潜在的な治療法として臨床的にテストされています(21)。重要なことに、CBDはウイルス感染に応答してサイトカインの活性化も抑制し、免疫細胞の動員とそれに続く肺やその他の影響を受けた組織内でのサイトカインストームの可能性を減らします。これらの結果は、CBDがマクロファージなどの動員された免疫細胞におけるサイトカイン産生を抑制することを示唆する以前の発見を補完します(22)。したがって、CBDは感染の初期段階で抗ウイルス剤として作用するだけでなく、後の段階で過剰な免疫系から宿主を保護する可能性があります。
CBDには、SARS-CoV-2に対する潜在的な予防薬として多くの利点があります。THCの含有量が0.3%未満の場合、CBDはアクセスを制限することなく広く利用できます。吸入や経鼻投与の可能性など、摂取には複数の手段があります。CBDは、細胞に侵入した後のウイルス複製をブロックするため、変異スパイクタンパク質を含むウイルス変異体に対して有効である可能性があります。レムデシビルや抗ウイルス抗体などの薬とは異なり、CBDの投与は病院での注射を必要としません。最後に、CBDは軽微な副作用のみに関連しています(15)。
しかし、CBDをCOVID-19の治療法として検討または調査する前に、いくつかの問題を綿密に調査する必要があります(11)。多くのCBD製剤が市場に出回っていますが、それらは品質、CBDの量、および経口投与後の薬物動態特性が大きく異なり、ほとんど知られていません。CBDは非常に疎水性であり、肝臓に閉じ込められて分解される大きなミセル構造を形成するため、経口投与後に他の組織が利用できる薬物の量が制限されます。不活性なキャリアは、臨床的に得られる濃度に大きな影響を及ぼします。CBDは食用油の調製品として広く販売されているため、フレーバーの市販の麻油を分析したところ、代表的なサンプルでCBD含有量はわずか0.30%でした(図S12)。)。CBDの純度、特にCBDとラベル付けされた材料の組成も重要であり、特にTHCなどの他のカンナビノイドがCBDの抗ウイルス効果に対抗するように作用する可能性があることを示唆する我々の発見に照らして重要です。これは、その法的地位に関連する問題に加えて、抗ウイルスCBDの効果的な供給源として機能するマリファナの実現可能性を本質的に排除します。最後に、vapingや喫煙などの他のCBD投与手段は、潜在的な肺の損傷についての懸念を引き起こします。
SARS-CoV-2感染を阻止する治療薬としてのCBDの可能性を完全にテストするには、臨床試験とともに患者へのCBD送達の最適な手段を探求する将来の研究が必要です。血漿中のCBDのクリアランス率はマウスよりもヒトの方がかなり低いため、動物モデルで前臨床試験を行うのではなく、臨床試験に移行することをお勧めします(15)。早期のSARS-CoV-2感染の予防と治療におけるCBDの役割を定義するために、既知の濃度と高度に特徴づけられた製剤を用いた慎重に設計されたプラセボ対照臨床試験を提唱します。インビボで必要な人間濃度と最適なルートと処方はまだ定義されていません。特にこの天然物を用いた厳密なランダム化臨床試験の知識がなくても、現時点で予防または治療療法として現在利用可能な製剤でCBDを服用したいという衝動に強く注意します(23)
謝辞
シカゴのSARS-CoV-2ホストレスポンスチームのメンバーに、特にジュリアンソルウェイ、リックモリモト、ニッシムヘイ、アンスパーリング、フアンファンチェン、ラファエルリー、レイモンドルース、シャノンエルフ、アレクサンダーに感謝します。 Muir、Gokhan Mutlu、Jay Pinto、Steven White、Nickolai Dulin、Ray Moellering、Viswanathan Natarajan、Leonitis Platanias、Karen Ridge、HuanHuan Chen プロトコルと訓練を受けた科学者を提供することにより、シカゴ大学ハワードテイラーリケッツ施設へのアクセスを容易にしてくれたドミニクミシアカスに感謝します。また、臨床データの分析を提案および促進してくれたNicoleRosnerとKathleenCagney、および薬物動態の問題を検討してくれたMarkRatainにも感謝します。シカゴ大学ゲノミクス施設(RRID:SCR_019196)、特にSandhiyaArunとPieterFaberに感謝します。RNAシーケンシングを支援してくれた。最後に、シカゴ大学の研究担当副学長であるカレン・キムと生物科学部門の学部長であるケネス・ポロンスキーの絶え間ない支援に感謝します。
資金:
この作品は以下によってサポートされていました:
シカゴ大学(MRR)からのBIGVision助成金
国立衛生研究所助成金R01GM121735(MRR)
国立衛生研究所助成金R01CA184494(MRR)
国立衛生研究所助成金R01AI137514(GR)
国立衛生研究所助成金R01AI127518(GR)
国立衛生研究所助成金R01AI134980(GR)
国立衛生研究所助成金R01CA219815(SAO)
国立衛生研究所助成金R35GM119840(BCD)
国立衛生研究所助成金P30CA014599(シカゴ大学総合がんセンター支援助成金)
競合する利益:
著者のうち5人(MRR、GR、LCN、DY、JMM)は、「抗ウイルス剤としてのカンナビジオールの使用方法」というタイトルの仮特許を出願しました。暫定患者の受領は、2020年11月30日にUSPTOによって承認されました。SAOは、OptiKira。、LLC(オハイオ州クリーブランド)の共同創設者およびコンサルタントです。
脚注
データと資料の入手可能性:分析で使用されるすべてのデータ、コード、および資料は、物質移動合意書(MTA)によって制限されている場合を除き、分析を再現または拡張する目的で、何らかの形で研究者が利用できます。生および処理されたRNA-seqデータはGEOデータベースに保管されます。
補足資料
材料および方法
図。S1からS12
表S1
参考文献
2. Galloway SE et al。、Emergence of SARS-CoV-2 B.1.1.7 Lineage-United States、December 29、2020-January 12、2021。MMWR MORBモータルWkly議員 70、95-99(2021)。[ PMC無料記事] [ PubMed ] [ Google Scholar ] 3. Hoffmann M. et al。、SARS-CoV-2細胞侵入はACE2およびTMPRSS2に依存し、臨床的に証明されたプロテアーゼ阻害剤によってブロックされます。セル 181、271-280 e278(2020)。[ PMC無料記事] [ PubMed ] [ Google Scholar ] 4. Jaimes J.、Millet J.、Whittaker G.、SARS-CoV-2スパイクタンパク質のタンパク質分解切断および新規S1 / S2部位の役割。SSRN、3581359(2020)。[ PMC無料記事] [ PubMed ] [ Google Scholar ] 6. Wang R. et al。、遺伝学的スクリーニングはSARS-CoV-2および一般的な風邪コロナウイルスの宿主因子を特定します。セル 184、106から119 E114(2021)。[ PMC無料記事] [ PubMed ] [ Google Scholar ] 11. Nelson KM et al。、The Essential Medicinal Chemistry of Cannabidiol(CBD)。JメッドCHEM 63、12137から12155(2020)。[ PMC無料記事] [ PubMed ] [ Google Scholar ] 12. Marker DF et al。、新しい小分子混合系統キナーゼ3阻害剤URMC-099は、ヒト免疫不全ウイルス関連神経認知障害のモデルにおいて神経保護および抗炎症性です。J Neurosci 33、9998から10010(2013)。[ PMC無料記事] [ PubMed ] [ Google Scholar ] 13. Abu Aboud O. et al。、KPT-9274によるNAMPTおよびPAK4の二重および特異的阻害は腎臓癌の増殖を減少させる。モルガンTHER 15、2119年から2129年(2016年)。[ PMC無料記事] [ PubMed ] [ Google Scholar ] 15. C. F。DEA。R.(FDA)、「アプリケーション番号210365Orig1s000」、Clinical Pharmacology and Biopharmaceutics Reviews(2017)。[ Google Scholar ] 16. Anil SM et al。、大麻化合物は、肺上皮細胞のCOVID-19関連炎症においてin vitroで抗炎症活性を示し、マクロファージにおいて炎症誘発性活性を示します。SCIのRep 11、1462(2021)。[ PMC無料記事] [ PubMed ] [ Google Scholar ] 17. Crawford KHD et al。、中和アッセイ用のSARS-CoV-2スパイクタンパク質を用いたレンチウイルス粒子の疑似タイピングのためのプロトコルと試薬。ウイルス 12、(2020)。[ PMC無料記事] [ PubMed ] [ Google Scholar ] 19. Blanco-Melo D. et al。、SARS-CoV-2に対する不均衡な宿主反応がCOVID-19の発症を促進する。セル 181、1036から1045 E1039(2020)。[ PMC無料記事] [ PubMed ] [ Google Scholar ] 20. O'Leary NA et al。、NCBIの参照シーケンス(RefSeq)データベース:現在のステータス、分類学的拡張、および機能アノテーション。Nucleic Acids Res 44、D733–745(2016)。[ PMC無料記事] [ PubMed ] [ Google Scholar ] 22. Muthumalage T.、Rahman I.、カンナビジオールは、マクロファージ、肺上皮細胞、および線維芽細胞における基底およびLPS誘発性の炎症反応を特異的に調節します。Toxicol APPL Pharmacol 382、114713(2019)。[ PMC無料記事] [ PubMed ] [ Google Scholar ] 23. Sorkin BC et al。、天然物研究の翻訳の改善:ソースから臨床試験まで。FASEB J 34、41から65(2020)。[ PMC無料記事] [ PubMed ] [ Google Scholar ]
このレポートを見て、日本のカンナビジオールの取り扱いについて調べてみました
厚生労働省は今年5月14日に開催した「大麻等の薬物対策のあり方検討会」で、大麻草由来の成分「カンナビジオール(CBD)」を抽出する際の部位規制を撤廃する方針を示しています。
成分規制についての改正案には、CBDは由来に関わらず輸入と製造を可能とし、幻覚作用を有する成分「テトラヒドロカンナビノール(THC)」は厚生労働大臣が医薬品として承認したものに限り認めるとの方針が示されましたが、商品によっては検査に引っ掛かる場合があるようでなので海外からの輸入など、慎重にしたほうが良さそうです。

『輸入の前に提出を受けた資料を元に、対象の CBD 製品が大麻取締法の「大麻」に該
当するか否かを判断します。』とあります。
詳細は厚生労働省の専門WEBサイトやPDFリンクを貼っておきます
ご自身で確認してみてくださいね☟
https://www.mhlw.go.jp/content/11120000/000638551.pdf
長文でしたが最後まで読んで頂きありがとうございました